Hayvanlarda Pseudomonas Enfeksiyonları Tarihçesi
P. aeruginosa, 1850’de Sedillot tarafından cerrahi yara pansumanlarında mavi renk değişikliği yapan bir ajan olarak tanımlanmıştır. İlk olarak Bacillus pyocyaneus ve daha sonra Pseudomonas pyocyanea olarak adlandırılmıştır. Piyosiyanin izolasyonu Lucke tarafından 1862’de yapılmıştır. Ancak bu organizma, Gessard’ın klasik çalışmaları
ile 1882’de saf kültür halinde izole edilmiştir.
1897’de Hitschman ve Kreibich, 1917’de Frenkel ve 1925’de Osler patojen bir bakteri olduğunu tanımlamışlardır. 1926 yılında California Üniversitesi’ndeki Dooren de Jong, Pseudomonas türlerini, çeşitli organik bileşiklerin karbon ve enerji kaynağı olarak kullanımına dayanan fenotipik özelliklerin göre sınıflandırmışlardır. 1966’da Buchanon, Holt ve Lessel Pseudomonas türlerini fenotipik özelliklerine göre sınıflamışlardır. Daha sonra DNA hibridizasyon çalışmaları başlamıştır. 1973 yılında Palleroni ve arkadaşları, nükleik asit hibridizasyon çalışmalarını genişleterek Pseudomonas’ları rRNA homolojilerine göre 5 gruba ayırmışlardır. Son yıllarda yapılan çalışmalarda bu cinsin sınıflandırılması yeniden düzenlenmiştir. (Şen & Halkman, 2006)
Genel Bilgiler
Pseudomonadaceae familyasına bağlı Pseudomonas cinsi bakteriler Gram negatif çomaklardır. Bu grupta bulunan P. mallei insan ve hayvanlarda Ruam adı ile bilinen Malleus’un etkenidir. Hastalık etkenleri ve hayvanlarda yaptıkları başlıca hastalıklar aşağıdaki gibidir.
P. mallei: Başta tek tırnaklı (at, katır, merkep) hayvanlar olmak üzere, insan, köpek, aslan ve kaplanlarda Malleus veya Ruam enfeksiyonuna neden olur.
P. aeruginosa: Hayvanlarda mastitis, arthritis, enteritis, pneumonia, peritonitis ve ürogenital sistem enfeksiyonlarına neden olur.
P. pseudomallei: Yalancı malleus (Melioidozis) hastalığını yapar. Bu hastalık genellikle rodentlerde örülmekle birlikte evcil hayvanlarda ve insanlarda da bildirilmiştir.
Etiyoloji
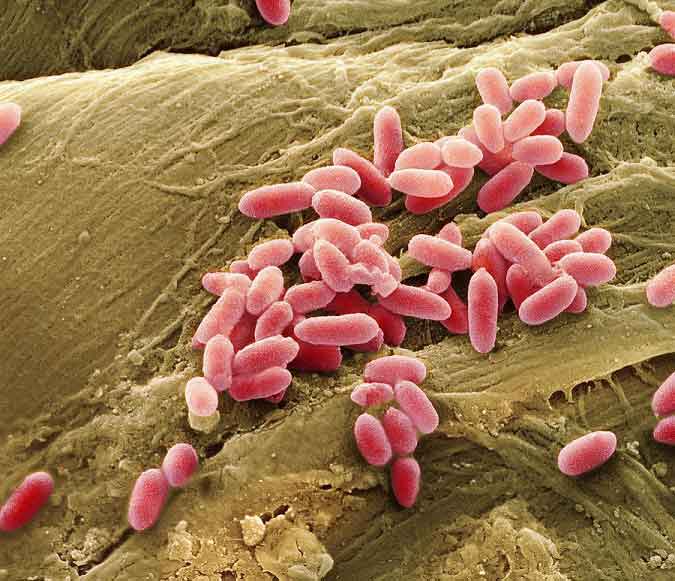
Pseudomonas aeruginosa sporsuz, polar flagellalı, hareketli, Gram negatif, genellikle kapsülsüz, bir mikroorganizmadır.
Kültürel ve Biyokimyasal Özellikleri
- Kanlı agarda hemoliz yaparlar. Tipik yeşil metalik parlaklık oluştururlar.
Pseudomonas aeruginosa on blood agar
P. aeruginosa ‘nın bazı biyokimyasal özellikleri şöyledir;
- Jelatin ve koagule plazmayı eriterek parçalarlar.
- Glikozu oksidatif yolla parçalayıp asit yaparlar (glukonat yapar). Laktoz ve sakkarozu kullanamazlar.
- Oksidaz pozitif olmaları ile Enterobacteriaceae familyası üyelerinden ayrılırlar.
- Asetamini deamine ederek amonyak oluştururlar.
- Nişastaya etki etmezler.
- Katalaz ve sitrat reksiyonları pozitiftir.
- L-arjinin dihidrolaz oluştururken, lisin dekarboksilaz ve ornitin dekarboksilaz oluşturmazlar.
- İndol ve H2S oluşturmazlar.
- Metil kırmızısı ve Voges-Proskauer negatiftir.
- Nitratı nitrite redükte ederler.
- Tetrazolium tuzlarını ve seleniti redükte ederler.
- KCN’ye dirençlidirler.
- Pseudomonas aeruginosa P. fluorescens’den ayrı olarak metilen mavisini ve prontosilin rengini giderir.
Kültürlerde bazen ikişerli, ancak çoğunlukla tek tek görülen ince düz, çomaklardır. Pseudomonas aeruginosa uygun besiyerinde optimum 30-370 C’lerde ve hafif alkali ortamlarda gelişir. 410 C ‘de üreyebilme yeteneği P. aeruginosa için önemli bir özellik olup arka arkaya 3 pasajda 42 0 C’de üreyebilmesi P. fluorescens ‘den ayırt edici bir özelliğidir. Aerob olmakla beraber denitrifikasyon özelliğinde olduğundan anaerob üreyen türlerine de rastlanabilir. Sıvı besiyerinde yüzeyde zar yapmak üzere yoğun ve homojen bir üreme gösterirler ve zarın hemen altında mavi yeşil pigmenti ayırt edilir. Uzun süre beklemiş kültür ortamları zamanla alkali duruma geldiğinden bakteriler litik fermentlerle erir ve sıvı besiyerini berraklaştırır. Peptonlu suda aynı şekilde ürerler.
P. aeruginosa katı besiyerlerinde 3 tip koloni oluştururlar. Tip 1 koloni, 2-3 mm çapında yuvarlak, mat yüzeyli, ortası kabarık, yassı, beyaz renkli karşıdan bakılınca fluoresans özelliği olan ve besiyerinin her tarafına yayılmış olan yeşil-mavi pigmentleri göze çarpan kolonilerdir. Bu tip koloniler genellikle klinik örneklerden izole edilir. Çoğunlukla doğal kaynaklardan izole edilen tip 2 koloni, daha küçük, kabarık, konveks ve düzensiz koliform kolonilerine benzeyen kolonilerdir. Tip 3 koloniler ise Pseudomonas aeruginosa ‘nın bazı suşlarının hücre dışı alginat salgılaması nedeniyle mukoid görünümde bakterinin oluşturduğu R kolonilerdir.
Kültürlerde triptofan 2-aminoasetofenon üretimine bağlı olarak karakteristik bir meyve kokusu vardır ve petri kutusunun kapağı açıldığında üzüm kokusu veya trimetilamin kokusu şeklinde hissedilir. Pseudomonaslar ısıya dirençsiz bakterilerdir. 55o C’de 1 saat ve 60o C’de 15dk’da ölürler. Çevre sıcaklığında sularda aylarca canlı kalırlar. Hastane ortamında zemin, hasta eşyaları ve organik maddeler içinde bulunurlar. İyi korunmayan antiseptiklerin ve bazı dezenfektanların içinde üredikleri bildirilmiştir. Distile su içinde bile ve oda sıcaklığında çoğalabilirler. Dörtlü amonyum bileşiklerinde, hekzoklorofenli sabunlarda, iyotlu solüsyonlar içinde bile üreyebilirler, hatta dörtlü amonyum bileşiklerini besin kaynağı olarak kullanabilirler. (Şen & Halkman, 2006)
Pseudomonas aeruginosa /Sebep olduğu hastalıklar Pseudomonas aeruginosa, insan ve pek çok hayvan türünde (sığır, koyun, keçi, domuz, at, köpek, kedi, mink, şinşila, sürüngenler gibi) çoğunlukla irinli ve bazen de akut sistemik enfeksiyonlara neden olan oportunistik patojen bir bakteridir. Etken ineklerde mastitis, metritis, pnömoni, dermatitis, arthritis, apse oluşumu, buzağılarda enteritis, köpeklerde otitis externa, pyoderma, oküler enfeksiyonlar, atlarda endometritis, şinşillalarda otitis media ve interna gibi klinik bozukluklar oluşturmaktadır. Pseudomonas aeruginosa insanlarda şiddetli hastane enfeksiyonları ile birlikte septisemi, endokarditis, solunum sistemi enfeksiyonları, dış ve orta kulak yangıları, korneal ülserler, menenjit, bağırsak, kemik ve üriner sistem enfeksiyonlarına neden olabilmektedir. Etken kistik fibrozisli ve ciddi yanık bulunan hastalarda ölümcül enfeksiyonlar oluşturabilir. Ayrıca, hastane enfeksiyonlarına sebep olarak yüksek mortalite ve morbiditeye neden olmaları ve tedavi maliyetlerini yükselttiklerinden dolayı önemli patojenler içinde yer almaktadır.
Biyofilm Tabakası Oluştururlar
Biyofilm, canlı veya cansız bir yüzeye yapışarak kendi ürettikleri organik bir ekzopolisakkarid matriks içine gömülü ve hareketsiz olarak birbirine, bir katı yüzeye veya bir ara yüzeye geri dönüşümsüz olarak tutunmuş halde yaşayan mikroorganizmaların oluşturduğu topluluktur. Pseudomonas aeruginosa güçlü biyofilm etkinliği olan bir patojendir. Antibiyotik tedavisinde mikroorganizmalara direnç kazandıran biyofilmler, antimikrobiyal tedaviyi engelleyici en büyük problemlerden biridir.
Biyofilm enfeksiyonları ilk dönemde genellikle asemptomatiktir. Konakçı direnci düştüğünde biyofilmden periyodik olarak kopup ayrılan planktonik (serbest formda) mikroorganizmalar akut enfeksiyona yol açabilir. Antibiyotiğin koruyucu dozları bu mikroorganizmaları kontrol ettiği halde biyofilmi etkilemez.
Biyofilm oluşumu ile karakterize enfeksiyonlara en iyi örneklerden biri insanlarda kistik fibroziste görülen Pseudomonas aeruginosa’ya bağlı kronik solunum yolu enfeksiyonlarıdır. Bu olguların yaşları ilerledikçe solunum yolları biyofilm oluşumu ile karakterize mukoid koloni fenotipinde P. aeruginosa ile kolonize ve enfekte olmakta ve bu aşamadan sonra kolonizasyon/enfeksiyonun eradikasyonu hemen hemen olanaksız hale gelmektedir. Mukoid koloni fenotipine dönüşüm bu olgularda belli bir süreyi bulmaktadır. Kistik fibroziste kronik inflamasyona bağlı olarak toksik oksijen radikallerinin solunum yollarındaki konsantrasyonu giderek artarak bakterinin genetik yapısında bazı mutasyonlara yol açmakta ve aktif hale gelen algT geni sayesinde bakteri mukoid ekzopolisakkaridleri sentezlemeye başlamaktadır. Diğer yandan kistik fibrozis olgularında solunum yollarında oksijen konsantrasyonu
normale göre düşük olduğundan P. aeruginosa daha çok anaerob koşullarda biyofilm içinde canlılığını sürdürmeyi tercih etmekte, bu durum da enfeksiyonun kronikleşmesine ve tedavinin güçleşmesine neden olmaktadır.
Bakteri biyofilm oluşumunu hücreden hücreye yollanan iletişim sinyalleri aracılığıyla kontrol etmektedir. Bu sinyal sistemi “Quorum sensing” olarak adlandırılmaktadır. “Quorum sensing” kavramı “minimum populasyon birimini algılama” olarak ifade edilebilir. “Quorum sensing” sinyalleri sayesinde bir odakta toplanan mikroorganizmalar biyofilmin temelini oluştururlar. “Quorum sensing” sistemi içinde en önemli rolü sinyal molekülleri üstlenir. Bu moleküllere aynı zamanda “autoinducer” da denilmektedir. Bakterilerdeki sinyal molekülleri Gram (-) bakterilerde asil homoserin lakton (AHL), siklik dipeptidler, gram-pozitif bakterilerde küçük peptidler, hem gram-negatif hem de gram-pozitif bakterilerde “autoinducer-2”dir. P. aeruginosa’ da AHL’ ye ek olarak Pseudomonas kinolon sinyal molekülü (PQS) bulunur. Bu molekül yapısal olarak kinolonlara benzemekte ve AHL’ ye bağlı “quorum sensing” sistemini modüle etmektedir. P. aeruginosa’ da AHL ailesi üyelerinin yer aldığı las ve rhl olmak üzere iki “quorum sensing” sistemi bulunmaktadır. Her iki sistemin de kistik fibrozis olgularının balgam örneklerinde aktif oldukları saptanmıştır. Bu olgularda görülen P. aeruginosa izolatlarının ortak özellikleri sıklıkla mukoid fenotipte olmaları, aşırı miktarda aljinat sentezlemeleri ve oluşturdukları enfeksiyonların antibiyotik tedavilerine yeterli yanıt ermemesi şeklinde sıralanabilir. Biyofilm içinde üreme sayesinde P.aeruginosa hem antibiyotiklerin etkisinden hem de akciğerlerdeki immun yanıttan korunmaktadır.
P.aeruginosa hastane enfeksiyonlarında önemli bir fırsatçı patojendir. P.aeruginosa virulans faktörlerinin sunumunu hücre, “quorum sensing” sayesinde kontrol edebilir. Virulans özelliklerinden olan biyofilm, kronik enfeksiyonlara zemin hazırlanır. Shih ve arkadaşları biyofilm – quorum sensing ilişkisini tanımladıkları çalışmalarında, P. aeruginosa doğal standart suş (PA01) ile “quorum sensing” den yoksun mutantları biyofilm oluşturma yönünden karşılaştırmışlar ve başlangıçta biyofilm yoğunluğu yönünden aralarında farklılık yokken, “quorum sensing” özelliği taşıyan doğal suşla biyofilm oluşumunun mantarlardan daha hızlı ilerlediğini göstermişlerdir.
Biyofilmde yer alan mikroorganizmalar antimikrobiyal ajanlara, planktonik şekillerine göre 200-500 kat daha dirençlidir. Herhangi bir şekilde antimikrobiyal ajanlara dirençli olmayan bir mikroorganizma biyofilm oluşturunca dirençli hale, biyofilmden ayrıldığında ise tekrar duyarlı hale dönüşebilmektedir.
Biyofilm ortamı sadece antibiyotiklere karşı değil, dezenfektanlara karşı da direnç gelişmesinde rol oynamaktadır. Biyofilm tabakası içindeki bakteriler sıvı ortamda serbest üreyen bakterilere göre dezenfektanlara 10-100 kat daha dirençlidir. Bu yolla oluşan direncin mekanizması tam olarak açıklığa kavuşmamakla birlikte; glikokaliks bileşimi, hücre dışı enzimler, besin sınırlaması, dezenfektanın hücrelere ulaşmasında zorluk gibi çeşitli faktörlerin ilişkili olduğu varsayılmaktadır. (Altun & Şener, 2008) Fenoller ve glutaraldehit genellikle Pseudomonas’lara etkili olan
dezenfektanlardır. (Şen & Halkman, 2006) Bu amaçla ACTON Dezenfektan Çözelti’nin 1/50 oranında sulandırılarak kullanılması P. aeruginosa’ yı inhibe etme bağlamında olumlu sonuç verecektir. Biyofilm içinde yavaş üreyen veya üremenin durağan fazında bulunan P. aeruginosa suşlarının betalaktamlara ve tetrasiklinlere duyarlılığının önemli ölçüde etkilendiği, florokinolon aktivitesinin ise üreme hızıyla etkileşmediği saptanmıştır. P. aeruginosa biyofilmlerinde siprofloksasin ve tobramisin aktivitesinin yüzeye yakın bölgedeki suşlarda daha yüksek olmasının saptanması da oksijen yoğunluğuna bağlanmaktadır. (Altun & Şener, 2008)
Hayvan sütünden insana geçer
Değişik kaynaklar, süte karışan Pseudomonas’ların sütte hızla çoğalıp, çeşitli fermantasyonlara, parçalanmalara neden olduğunu ve bu faaliyetler sonucunda sütün renginde kokusunda, yapı ve kıvamında birçok değişiklikler olduğunu göstermektedir. Sütte Pseudomonas’lar sütün tazeliğini bozduğu gibi bazen de çeşitli enfeksiyonlara neden olmaktadır. Özellikle fırsatçı patojen olarak bilinen Pseudomonas aeruginosa sütün çok fazla tüketildiği 0-3 yaş grubu çocuklara süt kaplarının temizliğine dikkat edilmediğinde bulaşıp hastalıklara ve salgınlara yol açarak halk sağlığını da tehdit etmektedir. (Şen & Halkman, 2006)
Laboratuar Tanısı – Serolojik Testler
- Hastalığın oluştuğu yere göre kan, idrar, BOS, irin, yara ve yanık sürüntüleri, balgam ve diğer bölgelerden alınan sürüntüler tanı için kullanılır.
- Alınan örnekler kanlı agar, MacConkey agar besiyerlerine ekilir. Kanlı agarda hemolizli, MacConkey agar da laktoz negatif R tipi, küçük kabarık veya mukoid koloniler görülebilir.
- Petri kutusu açıldığında açığa çıkan üzüm kokusu karakteristiktir.
- Pigment oluşumunun görülmesi Pseudomonas için kolay ve çabuk tanı koyulmasını sağlar.
- Hareketli, oksidaz pozitif olması tanıyı kesinleştirir.
- Gerekirse yukarıda bahsedilen biyokimyasal testler yapılarak da tanı kesinlik kazanır.
Tedavi
Pseudomanas aeruginosa yaygın olarak su, toprak ve bitkiler üzerinde bulunan çevresel kaynaklı saprofitik bir etkendir. Ayrıca sağlıklı hayvanların deri, müköz membran ve dışkılarında da yaşayabilir. Yaygın olarak kullanılan pek çok antibiyotiğe dirençli olduğundan gerek insanlarda gerekse hayvanlarda tedavi açısından sorunlar yaşanmaktadır. Çoklu ilaca dirençli tanımlaması güncel tanımlama ile sefalosporinler, karbapenemler, betalaktam ve betalaktamaz kombinasyonları, florokinolonlar ve aminoglikozidlerden en az ikisine dirençli olarak kabul edilir. İnsan, köpek, koyun ve sığırlardan izole edilen P. aeruginosa suşlarının pek çok antibiyotiğe dirençli olduğu araştırıcılar tarafından rapor edilmiştir.
Harran Üniversitesi Veteriner Fakültesi Mikrobiyoloji Anabilim Dalı’na, ithal Holstein ırkı sığırlardan oluşan 1000 başlık özel bir süt işletmesinde buzağılarda görülen enteritis, irinli deri yaraları, poliarthritis, apse gibi klinik bozukluklar ve % 24 (60/250) oranındaki ölümler nedeniyle başvurulmuş, alınan klinik materyallerin bakteriyolojik muayenesi sonucunda etken P. aeruginosa olarak identifiye edilmiştir. Elde edilen izolatın antibiyotik duyarlılığını saptamak için Kirby Bauer Disk Diffüzyon yöntemi ile ampisilin, amoksisilin, amoksisilin/klavulanik asit, sefoksitin, siprofloksasin, eritromisin, gentamisin, imipenem, norfloksasin, oksasillin, penisilin, rifampin, streptomisin, tetrasiklin, trimetoprim-sulfametoksazol ve vankomisin test edilmiştir. Çalışma sonucunda imipenem 21 mm zon çapı ile duyarlı olarak belirlenirken, diğer antibiyotiklerde zon oluşumu görülmemiş ve dirençli olarak değerlendirilmiştir.
Karbapenemler, genişlemiş spektrumlu betalaktamaz, ( CEPHANOM), (GSBL) enzimlerine ve AmpC enzimlerine dayanıklı olmaları, etki spektrumlarının oldukça geniş olması, bakteriyel membrandan hızla geçebilmesi gibi özellikleri nedeniyle özellikle çoklu dirençli Gram (-) bakteri enfeksiyonlarında ilk sırada kullanılan antibiyotik grubudur. Ancak geniş etki spektrumları nedeniyle karbapenemlerin özellikle ampirik tedavide yaygın olarak kullanılması, bu antibiyotiklere karşı direnç oranlarının artmasıyla sonlanmış olup, son yıllarda imipenem dirençli P. aeruginosa enfeksiyonları tüm dünyada sıklığı artan, önemli bir sağlık problemi olarak bildirilmektedir. European Antimicrobial Resistance Surveillance System (EARSS)’nin 2007 verileri Avrupa’da P. aeruginosa için karbapenem direncinin artmakta olduğunu göstermiştir ve Danimarka, Hollanda, Finlandiya, İsveç ve İsviçre gibi ülkelerde %
10 iken Türkiye, Hırvatistan, Almanya, İtalya, Çek Cumhuriyeti ve Yunanistan’da % 25 civarında olduğu rapor edilmiştir. Türkiye’de veteriner sahada kullanılan imipenem etken maddeli preparat bulunmamaktadır. Bu nedenle henüz imipenem direncinin gelişmediği düşünülmektedir. (KESKİN, TEL, & ARSERİM, 2012)
P. aeruginosa izolatları genellikle antipseudomonal penisilinlere (tikarsilin ve piperasilin), sefquinom sülfat ve aminoglikozidlere (gentamisin, tobramisin, amikasin), siprofloksasin’e, sefoperazon’a, seftazidim’e, meropenem’e ve imipenem’e hassastır. Antistafilokokkal penisilinler, sulbaktam-ampisilin, ampisilin, amoksisilin, amoksilin-klavulanik asit, 1. ve 2. kuşak sefalosporinler, sefotaksim, seftriakson, trimetoprim sulfametaksazol, nalidiksik asid’e doğal olarak dirençlidir. Tetrasiklinler, makrolidler, rifampin, kloramfenikol, sefiksim, sefpodoksime ise kural olarak
dirençlidir. Tikarsilin, piperasilin, seftazidim, sefepim, sefpirom, sefoperazon, karbapenemler ve aztreonam antipseudomonal betalaktamlardır. (DEDE, 2006)
Atlarda P. aeruginosa kaynaklı endometritis olgusunun tedavisinde steril suda tikarsilin ve klavulanik asit kombinasyonu 5-7 gün boyunca uterus içi lavaj yoluyla uygulanmıştır. Buna ilaveten kullanılan ve insanlarda da P. aeruginosa kaynaklı dermatolojik enfeksiyonlarda kullanılan gümüş nitrat solüsyonu, %1’lik gümüş sülfadiazin kremden daha iyi sonuç vermiştir. Sistemik tedavi için 34 güne kadar günde iki kere damar içi gentamisin sülfat uygulanmıştır ve sonuçlar başarılı olarak raporlanmıştır. (Ricketts, 1999)
Köpeklerde P. aeruginosa ile ilişkili bronşiektazi enfeksiyonlarında, amoksisilin klavulanik asit kombinasyonu hariç betalaktamlar uygun seçim değildir çünkü solunum yollarına penetrasyonları zayıftır. Florokinolonlar, tetrasiklinler, klindamisin, metronidazol ve azitromisin solunum yollarına iyi penetre olmaları sebebiyle uygun seçimlerdir. Makrolidler (özellikle azitromisin) biyofilm formasyonuna neden olan P. aeruginosa’ yı inhibe etmek için çok daha iyi bir seçimdir. (Morais)
Grenada’ daki köpeklerden çeşitli klinik koşullarda 44 P. aeruginosa suşu elde edilmiştir. İzolatların çoğunluğu otitis, dermatitisi de kapsayan deri hastalıkları, yara ve apselerden izole edilmiştir. İzolatlar 6 antibiyotiğe karşı standart disk difüzyon testiyle test edilmiştir. En az direnç sırasıyla gentamisine (%9.8), enrofloksasine (%15.8) ve neomisine (%41.8) karşı gelişmiştir. Tetrasikline % 85.3 oranında direnç oluşmakla beraber, tüm izolatlar amoksisilin klavulanik asit ve cephalothin’e doğal direnç göstermiştir. (Hariharan, Sylvester, & Matthew, 2009)
Brezilya da P. aeruginosa ile ilişkili otitis externa ve pyodermalı köpeklerin tedavisinde çeşitli antibiyotikler denenmek suretiyle bir direnç çalışması yapılmıştır. 11 pyoderma, 93 otitis externa olmak üzere toplam 104 P. aeruginosa suşu çalışmada kullanılmıştır. İzolatların çoğunlukla enrofloxacin (%72,2) ve ticarcillin’e dirençli oldukları gözlemlenmiştir. Ciprofloxacin (%7,7), tobramycin (%3,8) ve polymixin B (%0) ‘ ye karşı daha düşük bir direnç gelişimi tespit edilmiştir. (Arais, Barbosa, Carvalho, & Cerqueira, 2016)
Betalaktam antibiyotiklere karşı P.aeruginosa’ da, incelenen örneklere ve antibiyotik kullanma politikalarına göre değişebilen duyarlılık oranları gözlenmektedir. P.aeruginosa suşlarında seftazidim duyarlılığını araştıran çalışmalarda Karray ve ark. %77 duyarlılık saptarken, Cheng ve ark. bu oranı %29 olarak bildirmiştir. Türkiye de yapılan çalışmalarda seftazidim duyarlılığını Çolak ve ark. %75, Birengel ve ark. %53.4, Yücesoy ve ark. %49, Aydoğan ve ark. %47, Cesur ve ark. %45.1 olarak bildirmişlerdir. (GÜL, ŞENSOY, ÇETİN, KORKMAZ, & SEBER, 2004)
Bangladeş de yürütülen bir çalışmada, 2 sığırdan izole edilen 2 P. aeruginosa izolatına karşı bazı antibiyotiklerin duyarlılığı araştırılmıştır. Her iki izolatın antibiyotik duyarlılık testi disk difüzyon metoduyla saptanmıştır. Her iki izolat da, kanlı agarda B hemoliz oluşturmuş ve MacConkey agarda gelişim göstermiştir. Test edilen 10 antibiyotikten, en fazla direnç gelişimi ampisilin ve oksitetrasiklini takiben tetrasiklin ve amoksisiline karşı bulunmuştur. Orta derecede duyarlı antibiyotikler; kanamisin, eritromisin, gentamisin ve sülfametoksazol, yüksek derecede duyarlı olanlar ise; kloramfenikol ve siprofloksasin olarak tespit edilmiştir. Çalışma sonucunda, kloramfenikol ve siprofloksasin’in P. aeruginosa enfeksiyonu tedavisi için tercih edilebilecek en iyi etken maddeler olduğuna kanaat getirilmiştir. (M.G., S., M.M., J.K., & A.A., 2013)
P. aeruginosa kaynaklı sığır mastitis vakalarında, en etkili antibiyotiklerin karbapenisilin, kolistin, gentamisin ve polimiksin B olduğu yapılan araştırmalarca belirlenmiştir. Polimiksinlerin memeden emilimi zayıftır, fakat 5 mg/kg’lık kas içi enjeksiyonu sütteki duyarlı koliformları elimine etmeye yeterlidir. (Preez, 2000)
Hemorajik pnömonili minklerden izole edilen P. aeruginosa izolatına duyarlı olan antibiyotikleri saptamak için bir çalışma yapılmış ve sadece gentamisin ve kolistin duyarlı bulunmuştur. (Salomonsen, 2012)
2011 yılı içinde çeşitli klinik materyallerden soyutlanan P. aeruginosa suşlarının klinik örnek ve antibiyotik duyarlılık özelliklerinin araştırılması amaçlanmıştır. Çalışma süresince toplam 307 izolat elde edilmiştir. Elde edilen pseudomonaslarda amikasin direnci %1.3, imipenem direnci %11.4 ve piperasilin direnci %21.8 olarak saptanmıştır. Çalışma sonucunda tek başına kullanılmamakla beraber amikasin’in en etkin antibiyotik olduğuna kanaat etirilmiştir. (Duman, Kuzucu, Kaysadu, & Tekerekoğlu, 2012)
Celal Bayar Üniversitesi Tıp Fakültesi Hastanesinde, hastaların çeşitli klinik örneklerinden izole edilen 136 P.aeruginosa suşu değerlendirilmeye alınmıştır. Araştırılan suşların aminoglikozidlere olan duyarlılık oranları NCCLS standartlarına uygun olarak Mueller-Hinton agarda, Kirby-Bauer disk difüzyon yöntemi ile incelenmiştir. Her antibiyotik için duyarlılık zon çapının ölçülmesinde ve değerlendirilmesinde NCCLS standart sınır değerleri esas olarak alınmıştır. İsepamisin için 17 mm zon çapı sınır değer alınarak değerlendirilmiştir. İncelenen 136 suşun 130’u (% 96) isepamisin ve amikasine, 128’i (% 94) netilmisine, 124’ü (% 91) tobramisine ve 80’i (% 59) gentamisine duyarlı bulunmuştur. Altı suş (% 4) beş antibiyotiğe de dirençli bulunmuştur. (GÜNDÜZ, ARISOY, ALGÜN, & ÖZBAKKALOĞLU, 2004)
Korunma
Pseudomanas aeruginosa su, toprak ve bitkiler üzerinde bulunduğu için hayvanların içtiği sular, yemlerini yedikleri yerler izolasyon gerçekleştirilmediği taktirde risk altındadır. Sağlıklı hayvanların deri, müköz membran ve dışkılarında da yaşayıp, herhangi bir enfeksiyon durumunda ortaya çıkan fırsatçı bir patojen olduğu için, hastalık belirtisi gösteren hayvanlarla sağlıklı olan hayvanlar arasında temas önlemleri alınmalıdır.
P. aeruginosa’dan korunma, özellikle uzun vadeli mastitis kontrol programının bir parçası olmalıdır.
Bunun için alınabilecek önlemler şunlardır:
- Süthane (mandıra), gölet ya da su drenaj alanları korunmak üzere çitle kapatılmalıdır.
- Akış yönü süthaneye doğru olan su ve atık toplama alanlarını kaldırmak için adımlar atılmalıdır.
- Periyodik olarak su kaynakları test edilmelidir.
- Gluteraldehit bazlı dezenfektanlarla şüpheli zeminler ve ekipmanlar yıkanmalı (Acton)
- Yılda en az bir kez püskürtme nozulları ve yıkama hortumları değiştirilmelidir.
- Sağım için meme başlarını hazırlarken ortak yıkama bezi ya da süngeri kullanılmamalıdır.
- Sağım ünitesinde kirli ve ıslak emzikler bulunmamalıdır.
- Her sağımdan sonra meme başı daldırma aplikatörü yıkanmalıdır. (Germisid D)
- Ticari olarak tek kullanımlık tüplerde hazırlanmış olan antibiyotikler kullanılmalıdır.
- Meme için antibiyotik kullanırken tek kullanımlık meme kanülleri tercih edilmelidir.
- Kanüller saf alkol içinde saklanmalıdır.
- Somatik hücre sayımı programlarıyla rutin olarak sürünün içinde ki mastitis seviyesi izlenmelidir.
- Sağımda ineklere kullanılan emzikler yıkanıp sterilize edilmelidir. (Kirk & Mellenberger)